CRISPR系统Cas13研究进展、研究团队及核心论文
基因编辑技术是一种能够对生物体的基因组及其转录产物进行定点修饰或者修改的技术。CRISPR/Cas这项明星技术自问世以来,已经吸引了无数欢呼和掌声。CRISPR/Cas系统为细菌与古细菌中抵御外源病毒和质粒DNA入侵的获得性免疫机制系统。作为一种新型的基因组编辑技术,具有设计简单、特异性强、效率高等优点。
CRISPR/Cas系统可以分为两类:第一类系统的核酸酶由多个亚基组成;第二类系统特别受关注,其核酸酶由单一的蛋白组成,包括基于Cas9、Cas12和Cas13效应蛋白的II、V和VI型。其中最熟悉的 Cas9 蛋白广泛用于基因组编辑等工作,但是CRISPR-Cas9系统也有它的不足之处,即脱靶效应。
CRISPR 蛋白家族中的 Cas13 可以靶向RNA 进行基因编辑,其专注靶向RNA的功能补充了靶向DNA的CRISPR-Cas9系统。目前已经发现 Cas13a( 也被称为 C2c2)、Cas13b、Cas13c 和 Cas13d 这 4 种蛋白都具有该功能。上述蛋白由于具有 RNA 结合特性,从而被发展成为核糖核酸的检测器。
在中国科学院等最新发布的《2019研究前沿》报告上,“Cas13”入选生物科学领域TOP 10热点前沿。
Cas13发现及发展过程
2016年6月:张峰团队发明靶向RNA的全新CRISPR系统
张锋博士是近几年大热的CRISPR/Cas9技术的先驱开创者之一。在改良及进一步操控CRISPR/Cas9这一工具加速基因组研究的同时,张锋课题组也在寻求进一步扩大基因组编辑的工具箱。
2016年6月2日,美国麻省理工学院和麻省理工学院-哈佛大学博德研究所的张锋等在《Science》发文,揭示 C2c2 是第一个只靶向RNA而不是DNA的新型CRISPR系统。论文标题为“C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector[1]”。
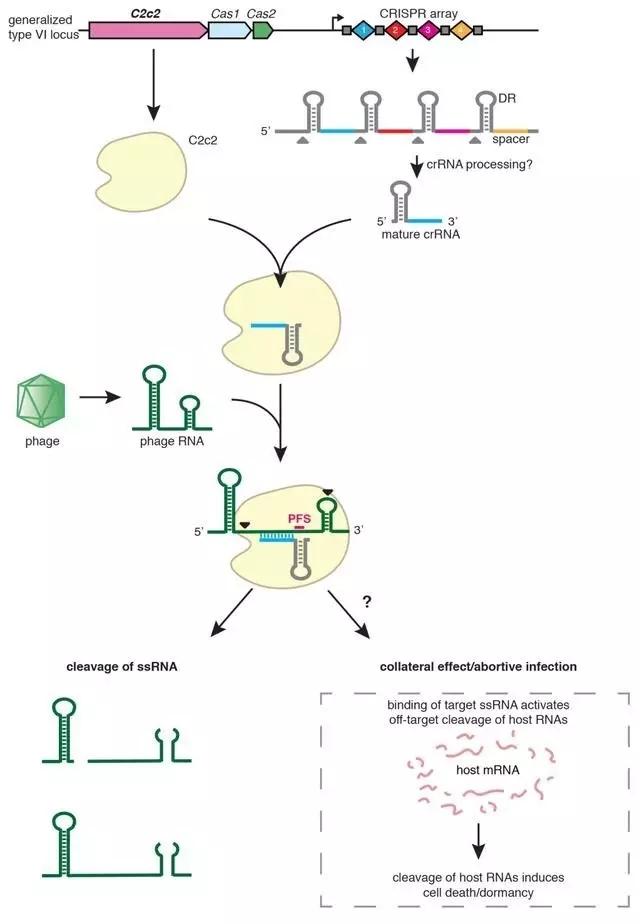
C2c2作用机理
C2c2专注靶向RNA的功能补充了靶向DNA的CRISPR-Cas9系统。如果说DNA是建构细胞形态和功能的“蓝图”,那么RNA就是将“蓝图”变为现实的“工程师”。因此,通过C2c2系统高通量地对RNA进行调控和改造,可实现对于基因功能在更广泛层面上的调节。这对于疾病的研究和防治均具有深远的意义。
该发现入选《Science》刊登的 20 项 2016 年最有意义的科研发现。
2016年9月:Jennifer Doudna团队扩大了C2c2的用途
随后,2016年 9 月,Jennifer Doudna 团队又扩大了C2c2蛋白的用途,发现 C2c2 有两种不同的 RNA 切割活性,而不是像先前研究中描述的只有1种。这两种不同的RNA切割活性有各自的功能:第一种是负责生产导向RNAs,使C2c2能够找到特定靶向的RNA分子;第二种是充当普通的RNA“剪刀”,用来破坏RNAs。
Jennifer Doudna团队的研究以“Two distinct RNase activities of CRISPR-C2c2 enable guide-RNA processing and RNA detection”[2]为题发表在9月26日的Nature杂志上。
2017年:王艳丽研究组等对 Cas13a 蛋白及其复合物进行了结构解析及机制分析
2017年,中国科学院生物物理所王艳丽研究组等对 Cas13a 蛋白及其复合物进行了结构解析及机制分析。王艳丽的研究组在2016年就开始利用结构生物学的方法研究Cas13a的结构和机理,并在2017年先后发表了两篇《Cell 》文章,阐明了不同来源的Cas13a结构。
2017年1月12日,Cell 杂志发表了王艳丽课题组关于Ⅵ型CRISPR-Cas系统的效应蛋白C2c2的结构研究。标题为“Two Distant Catalytic Sites Are Responsible for C2c2 RNase Activities”[3]。
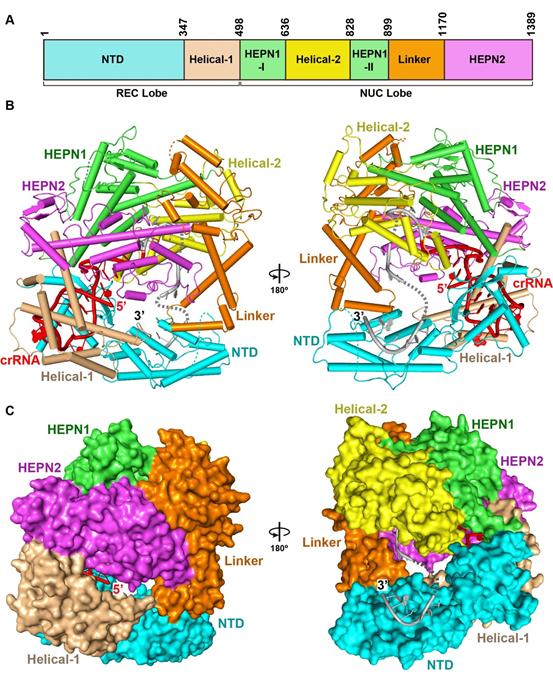
LshC2c2-crRNA的二元复合物的晶体结构
该研究解析了Leptotrichia shahii(Lsh)细菌中C2c2与crRNA (CRISPR-RNA) 的二元复合物以及C2c2在自由状态下的晶体结构,揭示了LshC2c2通过两个独立的活性结构域来发挥其两种不同的RNA酶切活性,这为研究C2c2发挥RNA酶活性的分子机制提供了重要的结构生物学基础。
2017年7月27日,Cell杂志在线发表了王艳丽组和章新政组在VI型CRISPR-Cas系统效应蛋白Cas13a(亦称C2c2)结构研究中取得的新进展。标题为“The Molecular Architecture for RNA-Guided RNA Cleavage by Cas13a. Cell[4]”。
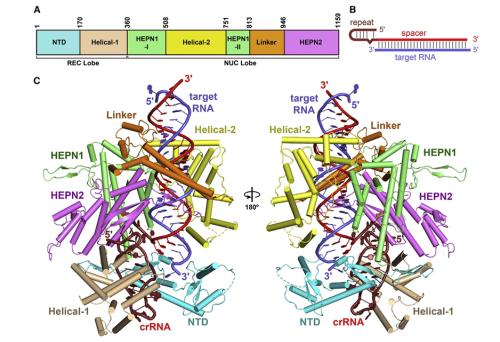
LbuCas13a-crRNA-target RNA三元复合物的晶体结构
该研究成功解析了Leptotrichia buccalis (Lbu)细菌中Cas13a与crRNA (CRISPR-RNA)及其target RNA三元复合物3.08Å的晶体结构、Cas13a与crRNA二元复合物3.2Å的电镜结构。研究结果证实target RNA的结合导致LbuCas13a的两个HEPN(发挥RNA干扰功能的结构域)结构域发生构象变化,从而激发LbuCas13a非特异性地切割任意单链RNA的酶切活性。该成果为研究Cas13a发挥RNA酶活性的分子机制提供了重要的结构生物学基础。
2017年2月:张峰团队又发现了两个新型的 RNA 靶向 CRISPR系统Cas13b 和 Cas13c
2017年2月16日,Molecular Cell杂志上刊登了张峰研究组的新成果。张锋的研究小组利用一种数据挖掘方法,又发现了两个新型的 RNA 靶向 CRISPR系统 Cas13b 和 Cas13c。论文标题为“Cas13b Is a Type VI-B CRISPR-Associated RNA-Guided RNase Differentially Regulated by Accessory Proteins Csx27 and Csx28[5]”
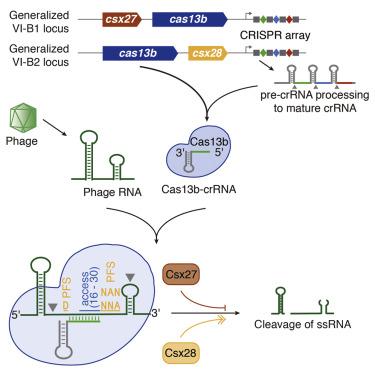
两个新型的 RNA 靶向 CRISPR系统
研究发现,Cas13b具有靶向和编辑RNA的能力。仅靶向RNA的这一能力使得研究人员能够以高通量地方式特异性地操纵RNA,从而用于研究广泛的生物过程。
像Cas13a一样,Cas13b仅需要单个向导RNA就能找到靶标,并且从遗传学的角度是可编码的。此外,Cas13b能够同时靶向多个RNA转录本。但Cas13b也有一些独特的特点,表明它与Cas13a是不同的。这些特性使得Cas13b更适用于微调基因功能。
2017年4月:张峰等开发基于CRISPR/Cas13a的诊断平台
CRISPR除了“基因魔剪”身份外,还是一种高效、简便、低廉的分子诊断工具。2017 年 4 月,张锋团队和 Jim Collins 团队等基于靶向 RNA 的 CRISPR-Cas13a/C2c2,开发的一种高度灵敏的检测器 ---“SHERLOCK”,可对特定病原体的核酸进行检测。
相关研究结果于2017年4月13日在线发表在Science期刊上,论文标题为“Nucleic acid detection with CRISPR-Cas13a/C2c2[6]”。
想用CRISPR 技术来治疗人类的疾病,光靠 DNA 编辑是不够的。因为不少疾病的根源在于 RNA。SHERLOCK的应用场景很广泛。它非但可以检测病毒感染和细菌感染,还可以“侦查”到耐药基因、癌细胞的突变。目前该系统已成功用于寨卡病毒和登革热病毒不同菌株的检测。
2018年2月:一日两篇《Science》展示Jennifer Doudna和张峰基于 CRISPR 系统开发的全新诊断工具
2018年2月15日,《科学》杂志在线发表两篇重磅文章,一篇为麻省理工著名学者张锋实验室的关于升级版基因突变检测技术“Sherlock V2”;另一篇为竞争如果对手加州大学伯克利分校的杜德拉教授团队开发的基于Cas12a(又叫Cpf1)的新的基因突变检测技术。
张锋团队:Sherlock v2 灵敏度提高100倍,可检测多种病毒

SHERLOCK 试纸检测结果展示
V2版结合了其他的Cas酶,实现同时检测4种不同类型的病毒或者突变,而且信号灵敏度也大大提高。论文标题“Multiplexed and portable nucleic aciddetection platform with Cas13, Cas12a, and Csm6.[7]”
Doudna 团队:100%准确检测出 HPV 16 感染
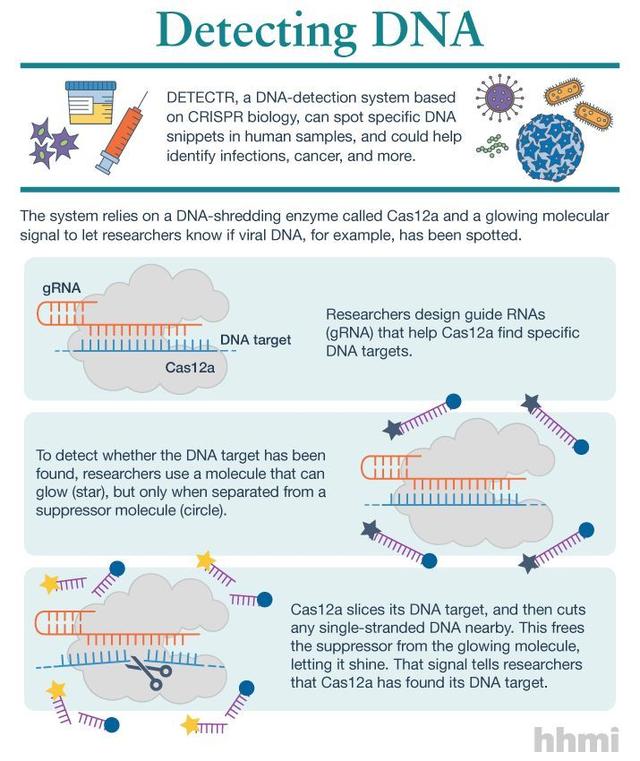
DETECTR 工作原理
Doudna 团队使用的是 CRISPR-Cas12a 系统。他们发现一个很有趣的现象:这种 CRISPR 系统在剪切靶向的双链 DNA 的同时,Cas12 的 DNA 酶活性会被激活,而该酶能非特异性切割单链 DNA(ssDNA)。论文标题:“CRISPR-Cas12a target binding unleashesindiscriminate single-stranded DNase activity.[8]”
2018年3月:Konermann等发现CRISPR新工具Cas13d
2018年3月15日,美国Salk研究所的Konermann等人在《Cell》在线发表一篇基因编辑重磅文章,分离出一种CRISPR-Cas蛋白新成员,属于Type VI-D型,叫做Cas13d,其能够有效地精准靶向降解RNA,在很多方面显示出比Cas13a更加强大的功能。论文标题“Transcriptome Engineering with RNA-Targeting Type VI-D CRISPR Effectors[9]”。
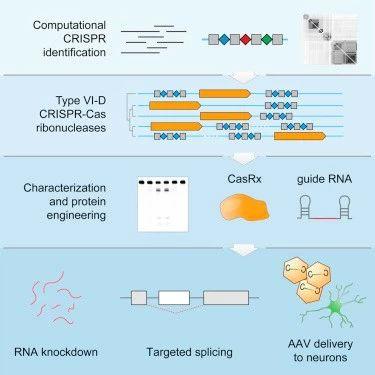
该研究的示意图
Cas13d是一种来自肠道细菌(黄化瘤胃球菌XPD3002)的CRISPR/Cas系统,被命名为CasRx。同Cas13类似,CasRx能够特异性的靶向并切割RNA,但比其他Cas13分子量小20%。同时CasRx介导的敲低效果相对于其他RNA调控方法具有更高的效率和特异性。
2018年9月:首次解析出CRISPR-Cas13d的三维结构
2018年9月20日的Cell期刊上,美国沙克生物研究所的研究人员首次解析出CRISPR-Cas13d的详细分子结构。论文标题为“Structural Basis for the RNA-Guided Ribonuclease Activity of CRISPR-Cas13d”[10]。
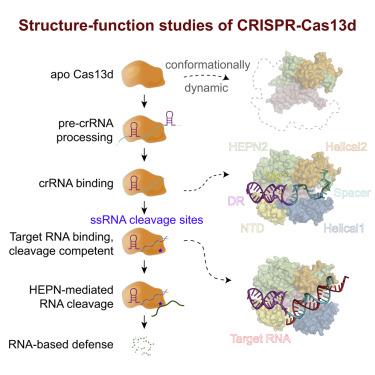
CRISPR-Cas13d的三维结构
研究人员通过让CRISPR-Cas13d在不同的动态状态下冻存,并利用cryo-EM解析出这种酶的新的结构细节,从而能够破解它的一系列活性,而不是仅在一个时间点观察到一种活性。
2019年10月:张锋团队再造三合一组合抗病毒的新型CRISPR Cas13系统
2019年10月10日,Molecular Cell 杂志发表了张锋研究组新进展。研究人员将Cas13的抗病毒活性及其诊断能力结合在一起,构建出一种未来有望用于诊断和治疗病毒感染的系统。他们的系统称为CARVER(Cas13辅助的病毒表达和读出限制)。论文标题为“Programmable Inhibition and Detection of RNA Viruses Using Cas13[11]”。
CARVER平台能将Cas13介导的病毒RNA裂解与基于Cas13的快速诊断读数结合起来,使用特定的高灵敏度酶报告分子解锁(SHERLOCK)平台,检测消灭基于RNA的病毒。
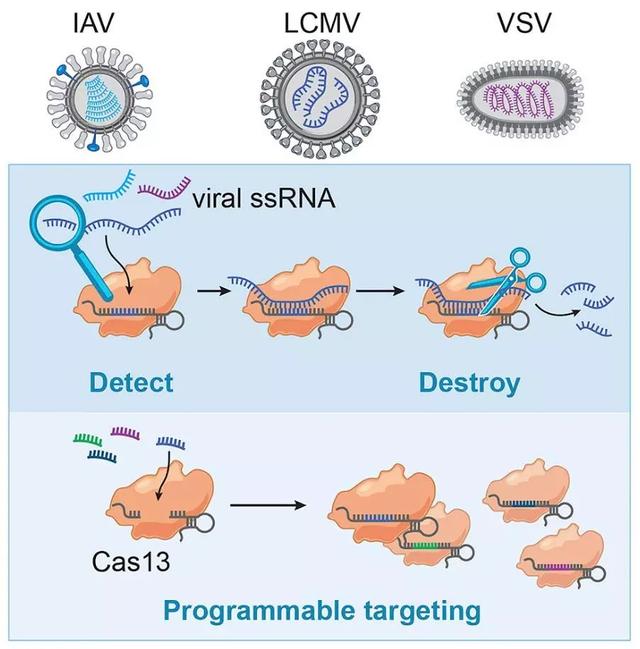
实验流程
这项新的研究是首批利用Cas13或任何CRISPR系统作为体外培养的人细胞中的一种抗病毒剂的研究之一。
2019年11月:陈玲玲组使用CRISPR-Cas13系统应用于RNA活细胞标记
2019年11月19日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈玲玲研究组在Molecular Cell杂志上在线发表了关于CRISPR-Cas13应用于RNA活细胞标记的最新研究进展。论文标题为:“Dynamic imaging of RNA in living cells by CRISPR-Cas13 systems[12]”。
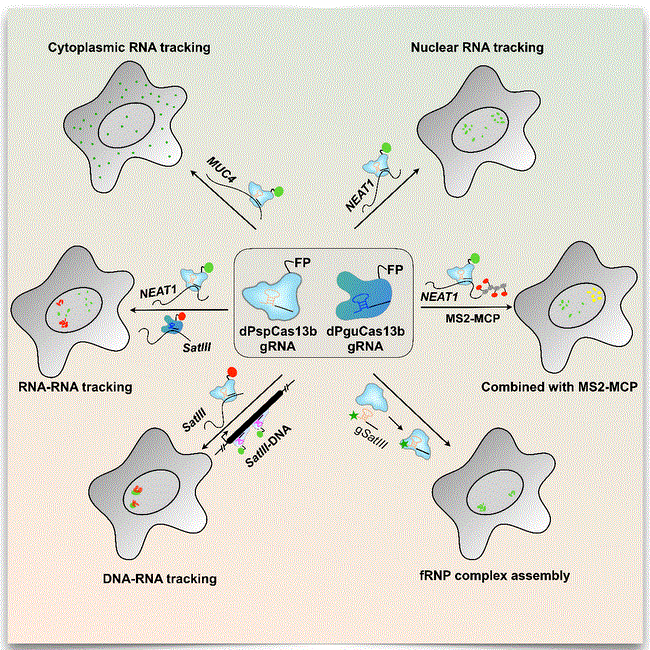
CRISRP-dCas13 在活细胞RNA标记上的应用
该研究对多种CRISPR-Cas13蛋白进行酶活突变后,筛选出了具有较好RNA标记能力的dPspCas13b和dPguCas13b蛋白,并且使用优化后的CRISPR-Cas13系统可以对胞浆和胞核的非编码RNA和mRNA进行有效标记。进一步联合dPspCas13b和dPguCas13b蛋白实现了对活细胞内不同RNA的双色标记,与CRISPR-Cas9联用实现了对转录RNA和基因位点同时标记。
Cas13核心研究团队及机构
据中国科学院等最新发布的《2019研究前沿》报告显示,Cas13研究前沿中施引论文的 Top 产出国家前三分别是美国、中国和德国。Top机构包括:哈佛大学、美国国家卫生研究院、中科院、麻省理工学院等。
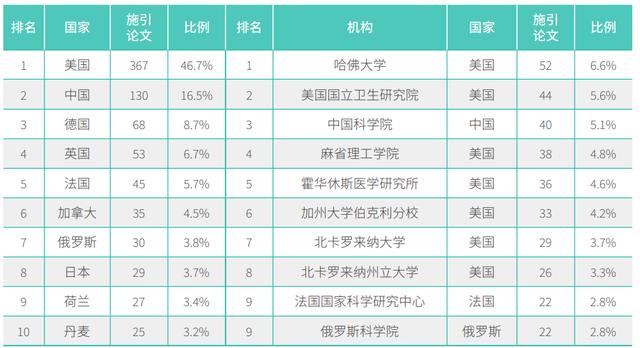
Cas13研究前沿中施引论文的 Top 产出国家和机构
在 CRISPR 的研究上,有两个先锋人物是不得不提,那就是麻省理工学院教授张锋和加州大学伯克利分校教授Jennifer A. Doudna。

▲Jennifer A. Doudna(左)和张锋(右)
张峰团队
张锋博士是近几年大热的CRISPR/Cas9技术的先驱开创者之一。张锋,2004年毕业于哈佛大学化学物理专业;2009年取得斯坦福大学化学与生物工程博士;2011年加入美国麻省理工学院(MIT)。
2013年,这位80后的年轻华人科学家开发出了可用来编辑DNA、敲除指定基因的CRISPR/Cas系统,自此之后一直致力于推动这一技术走向完美。
2017年1月成为麻省理工学院理学院(School of Science)的终身教授,成为麻省理工史上最年轻华人终身教授。
2019年3月,Collins、张锋等成立了Sherlock Biosciences公司,专注开发新型诊断/检测技术,用于多种不同的领域。4月,新锐公司Sherlock Biosciences宣布获得额外投资,A轮融资金额提高到了4900万美元。
Jennifer Doudna团队
加州大学伯克利分校的生物化学家Jennifer A. Doudna教授是基因组编辑技术变革的先驱之一,其带领的研究团队取得了诸多令人侧目的CRISPR研究成果。
据Doudna实验室官网显示,仅2016年,研究小组就在Cell、Nature、Science、Nature Biotechnology 、Nature Methods等杂志上发表论文近三十篇。
参考论文:
1.Abudayyeh, O. et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science. Online First: June 2, 2014.
2.Nature:Two distinct RNase activities of CRISPR-C2c2 enable guide-RNA processing and RNA detection
3.Two distant catalytic sites are responsible for C2c2 RNase activities Cell, 168(1), 121-134.
4.Liang Liu, Xueyan Li, Jun Ma et al. The Molecular Architecture for RNA-Guided RNA Cleavage by Cas13a. Cell, Published Online: July 27, 2017, doi:10.1016/j.cell.2017.06.050
5.Aaron A. Smargon, David B.T. Cox, Neena K. Pyzocha, et al.Cas13b Is a Type VI-B CRISPR-Associated RNA-Guided RNase Differentially Regulated by Accessory Proteins Csx27 and Csx28.Molecular Cell.January 5, 2017.
6.Nucleic acid detection with CRISPR-Cas13a/C2c2
7.Multiplexed and portable nucleic aciddetection platform with Cas13, Cas12a, and Csm6.
8.CRISPR-Cas12a target binding unleashesindiscriminate single-stranded DNase activity.
9.Konermannet al.,Transcriptome Engineering with RNA-Targeting Type VI-D CRISPR Effectors, Cell (2018),https://doi.org/10.1016/j.cell.2018.02.033
10.Cheng Zhang, Silvana Konermann, Nicholas J. Brideau et al. Structural Basis for the RNA-Guided Ribonuclease Activity of CRISPR-Cas13d. Cell, 20 Sep 2018, 175(1):212-223, doi:10.1016/j.cell.2018.09.001.
11.Catherine A.Freije et al. Programmable inhibition and detection of RNA viruses using Cas13. Molecular Cell, Published Online: 10 October 2019, doi:10.1016/j.molcel.2019.09.013.
12.Yang LZ, Wang Y, Li SQ, Yao RW, Luan PF, Wu H, Gordon G. Carmichael, Chen LL. Dynamic Imaging of RNA in Living Cells by CRISPR-Cas13 Systems. Mol Cell .2019 Nov 19. pii: S1097-2765(19)30802-0. doi: 10.1016/j.molcel.2019.10.024.
原文链接:https://www.xianjichina.com/special/detail_435684.html
转发来源:贤集网

